Polare Atombindung, Elektronegativität und Dipolmolekül
Die Elektronegativität beschreibt die Fähigkeit eines Atoms Elektronen an sich zu ziehen. Dies hängt zum einen davon ab, wie groß der Atomradius ist und zum anderen von der Anziehungskraft. Je größer der Atomradius ist, desto kleiner ist die Anziehungskraft des positiven Atomkerns auf die Elektronen. Die Anziehungskraft des Atomkerns selbst, steigt mit steigender Anzahl an Protonen, also mit steigender Ordnungszahl, von links nach rechts. Daher folgende Regel: Die Elektronegativität fällt mit der Hauptgruppe von oben nach unten. Sie nimmt von links nach rechts zu! Die Elektronegativität steigt aber nicht mit steigender Kernladungszahl, da mit jeder Periode eine weitere Schale dazu kommt. Dadurch sinkt die Anziehung des Atomkerns. Das elektronegativste Element ist Fluor mit 3,98.
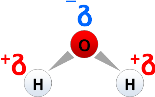
Eine polare Atombindung entsteht aufgrund der Elektronegativität. Atome, die eine Reaktion eingehen, und unterschiedliche Elektronegativitäten besitzen, bilden Teilladungen aus. Das Atom, welches die größere Elektronegativität besitzt, zieht die Elektronen des anderen Atoms zu sich und bildet eine negative Partialladung aus. Das Atom mit der geringeren Elektronegativität besitzt dann eine positive Partialladung. Diese Art von Bindung ist keine Ionenbindung, stellt aber eine Vorstufe dar. Die Literatur besagt, dass eine Atombindung eine Elektronegativitätsdifferenz (Delta-EN) zwischen 0,4 und 1,7 besitzt. Eine Ausnahme besitzen hierbei allerdings u. a. salzartige Verbindungen, die eher den Ionenbindungscharakter besitzen und sich aufgrund der Struktur erklären lassen. Ebenso sind nicht alle polaren Atombindungen gleichzeitig ein Dipol. Ein Dipol entsteht nur, wenn die Struktur nicht linear oder tetraedrisch aufgebaut ist, d. h. die Ladungsschwerpunkte sich nicht linear oder in einer Ebene befinden. Die Struktur des Moleküls muss asymmetrisch sein, wie z. B. bei Wasser:
Ein Dipol ist aber keinesfalls ein geladenes Molekül! Die Elektronen sind unsymmetrisch verteilt und das Gesamtmolekül ist elektrisch neutral geladen. Es sind nur Partialladungen definiert, die aufgrund der Ladungsumverteilung der Elektronen entstanden sind. Eine wichtige Rolle spielen aber auch freie Elektronenpaare eine Rolle. Diese freien Elektronenpaare befinden sich, in diesem Beispiel, oberhalb des Sauerstoff-Atoms und „drücken“ das Molekül so herunter, so dass es wie ein Dreieck aussieht. Es kann sich aber nicht falten, da sich die beiden Wasserstoff-Atome wiederum wegdrücken, wie zwei gleiche Pole beim Magneten.
[1] http://www.bs-wiki.de/mediawiki/index.php?title=Datei:Wasser-Dipol.png
Schwierigkeitsgrad 1
Arbeitsblatt-Nr. 11638